Получение гидроксида натрия каустификацией содового раствора
Рефераты по химии / Получение гидроксида натрия каустификацией содового раствораСтраница 8
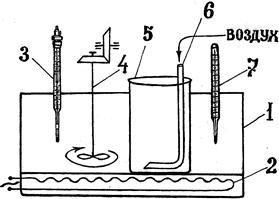
Схема установки для каустификации содового раствора
1 - термостат;
2 - электронагреватель;
3 - термометр сопротивления;
4 - мешалка;
5 - фарфоровый стакан-каустицер;
6 механическая мешалка или пневматическое перемешивание в виде трубки для подвода сжатого воздуха;
7 - дублирующий термометр.
11. Вопросы для самоконтроля
1) Значение гидроксида натрия в промышленности.
2) Методы получения едкого натра.
3) Сущность, достоинства и недостатки электролитического метода.
4) Основные реакции и сущность ферритного способа получения.
4) Сущность, достоинства и недостатки химического метода.
5) Цели лабораторной работы.
6) Формы выпуска едкого натра.
7) Каустификация содового раствора как характерный пример взаимодействия в системе жидкость - твердое (Ж-Т).
8) От какого соотношения зависит константа равновесия.
10) Способы повышения равновесной степени каустификации.
11) От чего зависит выбор оптимальной концентрации соды в исходном растворе.
12) Как влияет температура на процесс каустификации.
13) Характеристика вредных веществ, используемых в лабораторной работе.
14) Основные позиции дополнительной инструкции по технике безопасности.
15) Исходные вещества, необходимые для проведения лабораторной работы.
16) Приготовление 1 и 0,1Н соляной кислоты и определение их точной концентрации.
17) Приготовление карбоната натрия и определение его точной концентрации.
18) Определение содержания оксида кальция в негашеной извести, приготовление известкового молока.
19) Схема и принцип работы лабораторной установки.
20) Методика выполнения лабораторной работы.
21) Определение степени каустификации.
12. Контрольные задания
1. Получить гидроксид натрия каустификацией содового раствора. Определить практический выход реакции.
2. Изучить особенности протекания химического процесса по величине скорости реакции.
3. Установить влияние температуры процесса, соотношения исходных реагентов, времени протекания процесса на степень каустификации.
4. Составить материальный баланс процесса каустификации содового раствора при определенных параметрах технологического процесса.
13. Методика выполнения лабораторной работы
Способ и последовательность действий для проведения каустификации представлены в табл. 3.
В зависимости от задания проводятся опыты:
- при одной и той же концентрации содового раствора и извести и при разных температурах процесса;
- при одной температуре, но при разном соотношении исходных компонентов;
- при одном и том же составе реакционной смеси и температуре раствора, но при разном времени протекания процесса.
Для определения степени каустификации содового раствора анализ подвергается конечная реакционная смесь. Для определения скорости процесса проводится отбор проб по ходу протекания процесса.
14. Обработка результатов
Для расчета степени каустификации и других показателей оценки эффективности протекания процесса анализу подвергаются фильтрат и промывные воды для определения едкой (NaOH), карбонатной (Na2CO3) и известковой (Ca(OH)2) щелочи. Для этого проводят титрование соляной кислой с известной концентрацией NHCL в присутствии индикатора: для фильтра используется 1H раствор соляной кислоты, для промывных вод – 0,1Н раствор соляной кислоты. Совместное присутствие щелочных агентов усложняет анализ. Для идентификации каждого из компонентов применяется метод осаждения хлористым барием и оксалатом аммония.
Для определения общей щелочности 10 мл пробы переносят в коническую колбу, добавляют 10 мл дистиллированной воды и 3- 4 капли индикатора фенолфталеина и титруют раствором соляной кислоты до момента обесцвечивания розовой окраски (не перетитровать). Затем добавляют 3-4 капли индикатора метилового-оранжевого и дотитровывают кислотой до перехода окраски из желтой в розовую. Общее количество кислоты, израсходованное на титрование пробы с фенолфталеином и метиловым-оранжевым, отвечает общей щелочности и составляет V1 мл.
Для определения карбоната натрия сначала оценивают содержание едкой и известковой щелочи путем осаждения присутствующего с ним карбоната натрия (Na2CO3) с помощью хлорида бария. Для этого 10 мл
пробы переносят в коническую колбу, добавляют 10 мл дистиллированной воды и прибавляют 30 мл 25 %-ного раствора хлорида бария (BaCL2). При этом образуется нерастворимый карбонат бария и гидроксид бария по уравнениям реакции 6,7,8:
Na2CO3 + BaCL2 = BaCO3 ↓ + 2NaCl(6)
2NaOH + BaCL2 = Ba(OH)2 + 2NaCL(7)
Ca(OH)2 + BaCL2 = Ba(OH)2 + CaCL2(8)
К пробе после осаждения карбоната натрия добавляют 3-4 капли фенолфталеина и сразу немедленно титруют раствором соляной кислоты при осторожном помешивании до обесцвечивания розовой окраски. Долгое пребывание пробы исследуемого раствора на воздухе и интенсивное перемешивание ведут к значительному поглощению углекислого газа из воздуха. Количество кислоты, израсходованное на титрование эквивалентно содержанию едкого натра и гидроксида кальция, составляет V2 мл. Разность V1-V2 соответствует содержанию карбоната кальция в растворе, концентрация которого определяется по формуле 15:
Информация о химии
Бергиус (Bergius), Фридрих Карл Рудольф
Немецкий химик Фридрих Карл Рудольф Бергиус родился в Гольдшмидене (теперь это территория Польши), в семье Генриха и Марии (Хаазе) Бергиус. Мальчик посещал начальную и среднюю школы в расположенном неподалеку Бреслау (ныне польски ...
N — Азот
АЗОТ (лат. Nitrogenium — рождающий селитры), N (читается «эн»), химический элемент второго периода VA группы периодической системы, атомный номер 7, атомная масса 14,0067. В свободном виде — газ без цвета, ...
Полани (Polanyi), Джон Чарльз
Канадский химик Джон Чарльз Полани (Поланьи) родился в Берлине, в семье венгров по происхождению Майкла Полани и Магды Элизабет (Кемени) Полани. Когда мальчику было четыре года, семья переехала из Германии в Англию, в Манчестер, г ...


