Разделение урана и тория с помощью тонкослойных неорганических сорбентов
Рефераты по химии / Разделение урана и тория с помощью тонкослойных неорганических сорбентовСтраница 4
Таким образом, в случае многостадийного процесса (сорбция-десорбция и т.д.; экстракция-реэкстракция и т.д.) общее значение степени извлечения можно представить следующим образом:
N
Sобщ = П Si ,
i=1
где N - число стадий.
Сорбционное концентрирование компонента или компонентов в колоночном ("динамическом") варианте обычно осуществляется в две стадии. На первой стадии компонент из раствора, пропускаемого с определенной скоростью через сорбционную колонну (или в лабораторных масштабах - колонку), поглощается твердым веществом сорбента. Эту стадию характеризует так называемая "выходная кривая" (см. рис.1), которую обычно строят в координатах "концентрация компонента в вытекающем растворе" (ось ординат) и "пропущенный объем раствора" (ось абсцисс). Таким образом, после проведения всех анализов можно рассчитать степень извлечения компонента на стадии сорбции (S1):
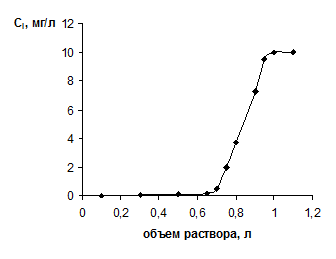
Рис.1 Выходная кривая сорбции урана сорбентом ТГ-Ц из имитата морской воды. С0 = 10 мг/л
n n
S1 = 1 - ( å
CiVi) / Co å
Vi, ,
i=1 i=1
где Co и Ci - концентрации компонента в исходном растворе и в i-й фракции вытекающего раствора соответственно; Vi - объем i-той фракции.
На второй стадии промывают колонку десорбирующим раствором, который по мере его вытекания из колонки также пофракционно анализируют на содержание компонента. По результатам анализа строят выходную кривую (см. рис.2), имеющую другой вид, и вычисляют степень извлечения на этой стадии:
k n
S2 = ( å
CjVj)/S1Co å
Vi, ,
j=1 i=1
где Cj - концентрация компонента в j-й фракции элюата (вытекающего десорбента) объемом Vj.
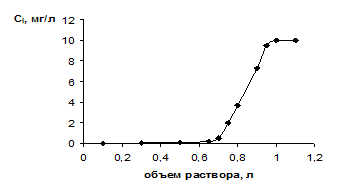
Рис.2. Выходные кривые десорбции урана раствором соляной кислоты
0.1 моль/л. 1 - дифференциальная; 2 - интегральная.
Ход работы:
Исходный раствор - нитрат уранила с концентрацией по урану 1-3 г/л, содержащий 10 - 50 мкг/л тория, рН раствора - 2,5-3,0. Сорбент - гидроксид титана, нанесенный тонким слоем на поверхность клиноптилолита, марка ТГ-Кл [12]. Порядок выполнения работы следующий. Отбирают 2 пробы исходного раствора по 0.5 мл, сушат и измеряют на b - радиометре (I0). Через колонку, заполненную сорбентом, пропускают раствор нитрата уранила (50 мл) со скоростью 1 мл/мин·см2, отбирая фракции по 10 мл. Из каждой фракции отбирают 2 пробы по 0,5 мл, сушат и проводят b - метрию. По полученным результатам строят выходную кривую сорбции тория в координатах " П - V " и рассчитывают выход тория на стадии сорбции (В1).
Колонку промывают 10 мл дистиллированной воды и затем проводят десорбцию, пропуская 10 мл 1 моль/л раствора щавелевой кислоты, отбирая фракции по 2 мл. Из каждой фракции отбирают 2 пробы по 0,5 мл, сушат и проводят b - метрию. По полученным результатам строят выходную кривую десорбции тория в координатах "Д - V"
Практическая часть:
1. Проведем сорбцию и десорбцию тория, измерим скорость счета проб на β - радиометре. Так же отберем пробы исходного раствора. Данные измерений и расчетов занесем в таблицу № 1.
Таблица № 1
|
Сорбция |
Десорбция | ||||||||||
|
N |
I1 |
I2 |
Iср |
Iср-Iф |
П |
N |
I1 |
I2 |
Iср |
Iср-Iф |
Д |
|
Фон |
27 |
23 |
25 |
- |
- |
- |
- |
- |
- |
- |
- |
|
1 |
36 |
36 |
36 |
11 |
0,08 |
1 |
2473 |
2490 |
2482 |
2457 |
0,664 |
|
2 |
30 |
30 |
30 |
5 |
0,04 |
2 |
203 |
198 |
201 |
176 |
0,047 |
|
3 |
36 |
32 |
34 |
9 |
0,07 |
3 |
70 |
75 |
73 |
48 |
0,013 |
|
4 |
40 |
36 |
38 |
13 |
0,10 |
4 |
52 |
51 |
52 |
27 |
0,007 |
|
5 |
40 |
42 |
41 |
16 |
0,12 |
5 |
53 |
54 |
54 |
29 |
0,008 |
|
Исх 1 |
178 |
165 |
161 |
136 |
- |
- |
- |
- |
- |
- |
- |
|
Исх 2 |
152 |
148 |
- |
- |
- |
- |
- |
- |
- | ||
Информация о химии
Майер (von Mayer), Юлиус Роберт фон
Немецкий врач и физик Юлиус Роберт фон Майер родился в Хейльбронне в семье аптекаря. Получив медицинское образование, он несколько месяцев работал в клиниках Парижа, после чего отправился в качестве корабельного врача на о. Ява. В ...
Пуанкаре (Poincare), Жюль Анри
Французский математик и физик Жюль Анри Пуанкаре родился в г. Нанси. Учился в Политехнической (1873-1875), затем в Горной (1875-79) школах в Париже. С 1886 г. профессор Парижского университета. Был членом Бюро долгот (с 1893). Тру ...
Br — Бром
БРОМ (лат. Bromum), Br, химический элемент VII группы периодической системы, атомный номер 35, атомная масса 79,904, относится к галогенам. Природный бром представляет смесь двух нуклидов с массовыми числами 79 (в смеси 50,56% по ...


