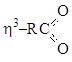Орбитальная симметрия и правила отбора
Рефераты по химии / Квантово-химические правила отбора элементарных стадий / Орбитальная симметрия и правила отбораСтраница 1
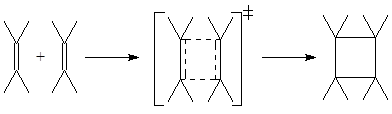
Общие правила отбора ЭС по симметрии МО в реагирующей системе с циклическим многоцентровым переходным состоянием сформулировали Р.Вудворд и Р.Хоффман – правила сохранения орбитальной симметрии в ходе согласованных реакций.
Если заполненные связывающие МО реагентов коррелируют по симметрии (имеют одинаковую симметрию) с заполненными связывающими МО продуктов реакции, такая реакция будет идти согласованно термически (как ЭС). В ходе такой реакции симметрия взаимодействующих орбиталей сохраняется вдоль координаты реакции по ППЭ. Если такой корреляции нет, согласованная реакция пойдет только фотохимически.
В простых молекулах анализ симметрии граничных орбиталей позволяет сделать заключение о возможности согласованной ЭС. Например, симметрии занятой s-МО молекулы Н2 и свободной s*-МО молекулы I2 не позволяют реализоваться циклическому переходному состоянию
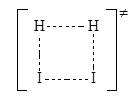
Это же касается и разрыхляющей s*-МО H2 и высшей занятой s-МО I2. Граничные ВЗМО и НСМО двух молекул этилена имеют разную симметрию и не могут образовать 4-членного переходного состояния при протекании ЭС
Занятая p-МО одной молекулы этилена
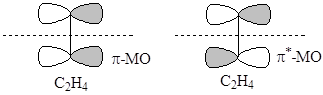
не может перекрываться синхронно со свободной p*-МО второй молекулы. Симметрия этих МО различна (относительно плоскости, проходящей перпендикулярно связи С-С через ее центр). В реакции бутадиена с этиленом, НСМО C4H6 (p1*-C4H6) имеет одинаковую симметрию с ВЗМО C2H4 и процесс протекает по согласованному 6-центровому механизму
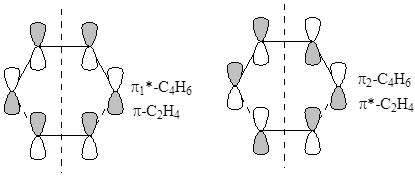
Аналогично и для перекрывания p*-C2H4 и НЗМО C4H6 (p2-C4H6).
Запрещенными по симметрии как элементарные стадии являются реакции присоединения молекул H2, Cl2, HCl, HF, HCN к кратным связям олефинов и алкинов (через 4-членное циклическое переходное состояние).
Реакции нуклеофильного и электрофильного присоединения и замещения, протекающие через линейные переходные состояния разрешены по симметрии. Участие переходных металлов (d-орбитали и d-электроны) в ЭС снимает запреты по симметрии и делает реакции согласованного присоединения по кратным связям металлосодержащих фрагментов разрешенными ЭС.
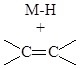 ,
, 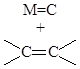 ,
, 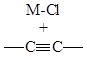 ,
, 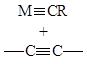
Разрешены по симметрии орбиталей также реакции присоединения молекул НХ к координированным атомом металла алкенам.
Правило сохранения 16-18 электронной оболочки Толмена в элементарных стадиях
Уже давно было отмечено (Сиджвик, 1929), что в стабильных комплексных соединениях общее количество электронов вокруг атома металла равно числу электронов ближайшего инертного газа. Это число электронов было названо эффективным атомным номером (ЭАН). В случае d-металлов число электронов в валентной оболочке металла, связанного с лигандами, должно быть равно 18 (d10s2p6). Такая оболочка и считается устойчивой. Например, Ni(CO)4: Ni0 d10, CO – 2-х электронный лиганд. Следовательно, 10 + 8 = 18. Для расчета числа электронов в комплексе металла необходимо сложить число электронов в валентной оболочке атома металла (или иона) и число электронов, предоставляемых нейтральными лигандами (или анионами). Для этого используют ковалентнуюи ионную
модели химической связи. В первом случае комплекс включает ионы Mn+, X– и нейтральные лиганды L, а во втором – атомы металла, нейтральные группы X (гомолитический разрыв связи M–X) и нейтральные лиганды L. Например, в комплексе HMn(CO)5 в валентной оболочке Mn имеем для ионной модели:
H– (2 эл) + Mn+ (6 эл) + 5CO (10 эл) = 18 эл.
для ковалентной модели:
H· (1 эл) + Mn0 (7 эл) + 5CO (10 эл) = 18 эл.
В таблице 2.1 приведены некоторые лиганды, их обозначения и количества электронов, предоставляемых металлу в рамках ковалентной и ионной моделей.
Таблица 2.1
|
Лиганды |
Символ лиганда |
Ковалентная модель |
Ионная модель |
|
Me, Ph, H, Cl, OH, CN |
X |
1 эл |
2 эл |
|
CO, NH3, H2O, PR3, R2S |
L |
2 эл |
2 эл |
|
C2H4 |
L |
2 эл |
2 эл |
|
H2 |
L |
2 эл |
2 эл |
|
|
LX |
3 эл |
4 эл |
|
h3–C3H5 |
LX |
3 эл |
4 эл |
|
h3–C5H5 |
L2X |
5 эл |
6 эл |
|
h3–C6H6 |
L3 |
6 эл |
6 эл |
Информация о химии
Усилитель поможет алмазу следить за атомами
Исследователи из Оксфорда и Сингапурского университета заявляют, что молекула-«усилитель», размещенная на острие алмаза, может оказаться полезной в обнаружении и идентификации отдельных атомов. Новая идея основана на ...
Sm — Самарий
САМАРИЙ (лат. Samarium), Sm, химический элемент III группы периодической системы, атомный номер 62, атомная масса 150,36; относится к лантаноидам. Свойства: металл, плотность 7,536 г/см3, tпл 1072 °C. Название: самарий назва ...
Ван Гельмонт (van Helmont), Ян Баптист
Голландский естествоиспытатель, врач и теософ-мистик Ян Баптист ван Гельмонт родился в Брюсселе; в Лувене он получил теологическое и медицинское образование и, в частности, изучал «каббалу». Сделавшись врачом и тщатель ...