Растворы электролитов. Изотонический коэффициент. Теория электролитической диссоциации. Степень электролитической диссоциации. Понятие об активности
Рефераты по химии / Общая и неорганическая химия / Растворы электролитов. Изотонический коэффициент. Теория электролитической
диссоциации. Степень электролитической диссоциации. Понятие об активностиСтраница 3
Поскольку диссоциация является обратимым равновесным процессом, то к этой реакции применим закон действующих масс, и можно определить константу равновесия как
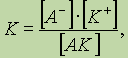
где К — константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.
Диапазон констант равновесия для разных реакций очень большой — от 10-16 до 1015. Например, высокое значение К для реакции
![]()
означает, что если в раствор, содержащий ионы серебра Ag+, внести металлическую медь, то в момент достижения равновесия концентрация ионов меди [Cu2+] намного больше, чем квадрат концентрации ионов серебра [Ag+]2. Напротив, низкое значение К в реакции
![]()
говорит о том, что к моменту достижения равновесия растворилось ничтожно малое количество иодида серебра AgI.
Обратите особое внимание на форму записи выражений для константы равновесия. Если концентрации некоторых реагентов существенно не изменяются в процессе реакции, то они не записываются в выражение для константы равновесия (такие константы обозначаются К1). Так, для реакции меди с серебром неправильным будет выражение
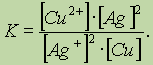
Правильной будет следующая форма записи:
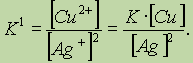
Это объясняется тем, что концентрации металлических меди и серебра введены в константу равновесия. Концентрации меди и серебра определяются их плотностью и не могут быть изменены. Поэтому эти концентрации нет смысла учитывать при расчете константы равновесия.Аналогично объясняются выражения констант равновесия при растворении AgCl и AgI.
Разбавленные растворы электролитов – солей, оснований, кислот в воде – показывают систематические отклонения от свойств идеальных растворов. Эти отклонения связаны с тем, что молекулы электролита в водном растворе распадаются на ионы, и в единице объёма раствора будет содержаться большее число частиц, чем в исходной загрузке соли, кислоты, основания. Для расчета свойств разбавленных растворов электролитов необходимо уравнения законов идеальных растворов исправить, введя в них коэффициент, учитывающий изменение числа частиц в растворе вследствие диссоциации или ассоциации растворенного вещества. Этот коэффициент обозначают i и называют изотоническим коэффициентом. Он показывает отношение числа частиц, образующихся в растворе, к числу частиц в исходной порции вещества. Для электролитов:
АВ = А+ + В-
N(1-б) Nб Nб
б=N1/N
N1 – число образовавшихся ионов или распавшихся молекул
N(1-б) – число нераспавшихся молекул
У Ni = N - Nб +Nб +Nб i= У Ni/N = 1+б
если исходные молекулы распадаются на н новых частиц, то
У Ni = N[1+б(н-1)] i= У Ni/N = 1+б(н-1)
если б=0, то i=1, если б=1, то 1<= i <= н
Для раствора, в котором молекулы растворенных веществ ассоциируют друг с другом:
nA = An
N(1-б) Nб/n
Nб/n – число ассоциированных молекул
N(1-б) – число исходных молекул
У Ni = N - Nб +Nб/n i= У Ni/N = 1+б(1/n -1)
1/n <= i <= 1
С учетом этой поправки законы разбавленных растворов электролитов запишутся:
р = i cRT
∆p/po = i n2/(n1 + i n2), ∆p/po = i n2/n1
i = роп/ррасч = (∆p/p)оп/(∆p/p)расч = ∆T3 оп /∆T3 расч = ∆Tк оп /∆Tк расч
Между активностью a2 сильного электролита в растворе (если формально не учитывать его диссоциацию на ионы) и средней активностью ионов электролита
y± ![]()
Рассмотрим несколько способов определения среднего коэффициента активности электролита y± по равновесным свойствам раствора электролитов.
25. Сильные и слабые электролиты. Константа диссоциации. Закон разбавления Оствальда. Слабые электролиты. Константа диссоциации
Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:
АaВb <––> aАx- + bВy+
константа диссоциации выразится следующим соотношением:
![]() (III.21)
(III.21)
Для бинарного (распадающегося на два иона) электролита выражение (III.21) можно переписать в виде (III.21a):
![]() (III.21a)
(III.21a)
Поскольку концентрация каждого иона для бинарного электролита равна произведению степени диссоциации б на общую концентрацию электролита С, выражение (III.21a) в этом случае можно переписать следующим образом:
Информация о химии
O — Кислород
КИСЛОРОД (лат. Oxygenium), O (читается «о»), химический элемент с атомным номером 8, атомная масса 15,9994. В периодической системе элементов Менделеева кислород расположен во втором периоде в группе VIA. Природный ки ...
Химия почв
Химия почв — это раздел почвоведения, изучающий химические основы почвообразования и плодородия почв. Основой для решения этих вопросов служит исследование состава, свойств почв и протекающих в почвах процессов на ионно-мол ...
Лекок де Буабодран (Lecoq de Boisbaudran), Поль Эмиль
Французский химик Поль Эмиль Лекок де Буабодран родился в г. Коньяк в семье винодела. Образование получил, самостоятельно занимаясь по программе Политехнической школы. С 1854 г. работал в винодельческой фирме своего отца в Коньяке ...


