Скорость химических реакций. Катализ. Гомогенный и гетерогенный катализ
Рефераты по химии / Общая и неорганическая химия / Скорость химических реакций. Катализ. Гомогенный и гетерогенный катализСтраница 1
Под скоростью химической реакции понимается изменение концентрации одного из реагирующих веществ в единицу времени. Концентрация вещества определяется числом молей в литре.При этом безразлично, о каком из участвующих в реакции веществ идет речь: псе они связаны между собой уравнениями реакции. По изменению концентрации одного из веществ можно судить о соответствующих изменениях концентраций всех остальных.При рассмотрении вопроса о скорости реакции необходимо различать гомогенные
и гетерогенные
реакции.Гомогенные
реакции протекают в однородной среде, например в смеси газов или в водном растворе. Например:
2S02 + 02 -> 2SOsгаз газ газ
Гетерогенные реакции идут на поверхности соприкосновения твердого вещества и газа, твердого вещества и жидкости и т. д. Например:
Fe + 2HCl-> FeCl2 + H2t
твердое раствор
В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно.Скорость гомогенной реакции математически можно отразить так:
V=+,- дельта с/дельта t
v — скорость реакции в гомогенной системе;с,, с2 — начальная и конечная концентрации одного из веществ, измеряемая числом молей в литре (моль/л);г,, t2 — моменты времени (секунды, минуты).Если речь идет о концентрации исходного вещества (концентрация которого с течением времени уменьшается), то берется знак «-». Если скорость оценить увеличением концентрации одного из продуктов реакции, то берется знак «+».Скорость реакции выражается в моль/л.
Катализом называется явление увеличения скорости или возбуждения хим. р-ии происходящей под действием некоторых веществ. Вещества, в присутствии которых наблюдается указанное явление называются катализаторами. Катализаторы, участвуя в р-ии, по её завершении вновь регенерируются, оставаясь неизменными. Различают гомогенный, когда катализатор и реагирующие вещества находятся в одной фазе, гетерогенный, когда катализатор и реагенты в разных фазах, кроме этого выделяют ферментативный катализ, когда катализатором являются ферменты. Микрогетерогенный катализ, когда катализатор присутствует в каллойдном состоянии, размер частиц см. особенности: 1) катализатор изменяет скорость лишь таких р-ии, которые т/д возможны при данных условиях ![]() . Прежде чем подбирать катализатор для той или иной р-ии нужно убедиться в её т/д возможности.
. Прежде чем подбирать катализатор для той или иной р-ии нужно убедиться в её т/д возможности.
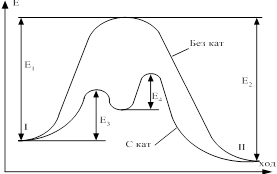
2) Катализатор непосредственно участвует в р-ях, образовывая промежуточные соединения, изменяя тем самым число и вид элементарных стадий процесса. Схематично можно представить так. Пусть для р-ии А+В=С+D катализатор является вещество К, тогда в присутствии катализатора схема может быть такой А+К→АК (а), АК+В=C+D+K (б). Р-ии (а) и (б) идут во много раз быстрее, чем р-ии непосредственного взаимодействия без катализатора. Промежуточное соединение в катализе это не обычное устойчивое хим. соединение, которое может быть выделено в чистом виде или может существовать в виде отдельной фазы. В гомогенном катализе это очень не стойкие соединения с малым временем жизни. В гетерогенном катализе это поверхностное соединение, не существующее в виде отдельной фазы, свойства которого резко отличаются от свойств аналогичного соединения образовывающего объёмную фазу.
3) Катализатор не изменяет величины теплового эффекта р-ии, в противном случае имело бы место не соблюдения з. сохранения и превращения энергии.
4) Катализатор не изменяет величины константы равновесия ∆H,∆S, ∆U, ∆F. Это означает, что равновесие, выход в присутствии катализатора остаётся тем же самым. Катализатор изменяет кинетические характеристики р-ии (EАКТ и предэкспоненты PZ0). действие катализатора может быть объяснено энергией активации процесса. Е3 и Е4 – энергии активации при образовании промежуточных соединений (а) и при его распаде (б), вследствие того, что энергия активации Е1 заменяет меньшую энергию Е3 и Е4 2-ух последних стадий скорость р-ии возрастает, даже если Е3+ Е4.>Е1 CH3CHO→CH4+CO при t=518єC ЕАКТ=45.5 ккал/моль в присутствии паров J2 энергия активации снижается до ЕАКТ=32,5 ккал/моль. Скорость возрастает в 10000 раз. Катализатор ускоряет и прямую и обратную р-ии в равной мере, при этом константа равновесия не изменяется. А время достижения системой равновесного состояния уменьшается.
5) Катализатор действует избирательно. Различные катализаторы могут или одну р-ию или группу р-ий или же р-ии различного класса в соответствии с этим катализаторы могут обладать индивидуальной специфичностью, групповой специфики или являться универсальными. Особое значение катализаторов имеет и используется при протекании в параллельных р-иях.
Информация о химии
Четыре первоэлемента
Эти представления были объединены в натурфилософии Эмпедокла из Агригента – создателя теории четырех начал мироздания. В различных вариантах его теория властвовала над умами людей более двух тысячелетий. Согласно Эмпедоклу, ...
Специальные варианты высокоэффективной жидкостной хроматографии
...
Ар-Рази, Абу Бакр Мухаммед ибн Закарийа (Разес)
Иранский учёный-энциклопедист, врач, алхимик и философ Абу Бакр Мухаммед ибн Закария Ар-Рази (латинизированное имя Разес, Rhazes) родился в персидском городе Рее, близ Тегерана. В Персии, а также в городах, расположенных на террит ...


