Квантово-механическая модель атома. Квантовые числа. Атомные орбитали. Порядок заполнения орбиталей электронами
Рефераты по химии / Общая и неорганическая химия / Квантово-механическая модель атома. Квантовые числа. Атомные орбитали.
Порядок заполнения орбиталей электронамиСтраница 3
Состояние электрона характеризующееся различными значениями главного квантового числа ![]() , называется электронным слоем (электронной оболочкой, энергетическим уровнем). Они обозначаются цифрами 1, 2, 3, 4, 5, … или соответственно буквами K, L, M, N, O ….
, называется электронным слоем (электронной оболочкой, энергетическим уровнем). Они обозначаются цифрами 1, 2, 3, 4, 5, … или соответственно буквами K, L, M, N, O ….
Квантовое состояние атома с наименьшей энергией – основное состояние, а с более высокой – возбуждённое состояние. Переход электрона с одного уровня на другой сопровождается либо поглощением, либо выделением энергии: ![]() .
.
Побочное квантовое (орбитальное, азимутальное) число ![]() (принимает все целочисленные значения от 0 до (n-1)).
(принимает все целочисленные значения от 0 до (n-1)).
|
|
|
Орбиталь |
|
1 |
0 |
1s |
|
2 |
0,1 |
2s,2p |
|
3 |
0,1,2 |
3s,3p,3d |
Состояние электрона характеризующееся различными значениями побочного квантового числа ![]() называется энергетическим подуровнем. В пределах каждого уровня с увеличением
называется энергетическим подуровнем. В пределах каждого уровня с увеличением ![]() , растёт энергия орбитали.
, растёт энергия орбитали.
Каждому значению ![]() соответствует определённая форма орбитали (например, при
соответствует определённая форма орбитали (например, при ![]() – это сфера, центр которой совпадает с ядром).
– это сфера, центр которой совпадает с ядром).
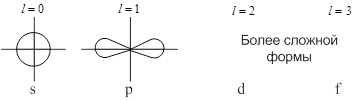
Магнитное квантовое число ![]() характеризует ориентацию орбитали в пространстве (принимает все целочисленные значения от -
характеризует ориентацию орбитали в пространстве (принимает все целочисленные значения от - ![]() до +
до +![]() ).
).
Например, для ![]()
![]() . В пределах каждого подуровня орбиталь имеет одинаковую энергию.
. В пределах каждого подуровня орбиталь имеет одинаковую энергию.
Спиновое квантовое число ![]() характеризует вращательный момент, который приобретает электрон в результате собственного вращения вокруг своей оси (принимает два значения:
характеризует вращательный момент, который приобретает электрон в результате собственного вращения вокруг своей оси (принимает два значения: ![]() – вращение по часовой стрелке,
– вращение по часовой стрелке, ![]() – вращение против часовой стрелки).
– вращение против часовой стрелки).
Атомные орбитали заполняются электронами в соответствии с 3-мя принципами:
Информация о химии
Таубе (Taube), Генри
Канадо-американский химик Генри Таубе родился в Ньюдорфе (провинция Саскачеван, Канада), в семье Альбертины (Тайдетски) Таубе и Самюэла Таубе. Окончив местную школу, он поступил в Саскачеванский университет, где в 1935 г. получил ...
Онзагер (Onsager), Ларс
Норвежско-американский химик Ларс Онзагер родился в Осло, в семье Эрлинга Онзагера, адвоката Верховного суда Норвегии, и Ингрид (Киркеби) Онзагер. Посещая школу в Осло, он изучал литературу, норвежские саги, философию и искусство. ...
Er — Эрбий
ЭРБИЙ (лат. Erbium), Er, химический элемент III группы Периодической системы, атомный номер 68, атомная масса 167,26, относится к лантаноидам. Свойства: металл. Плотность 9,045 г/см3, tпл 1522 °С. Компонент магнитных сплавов ...


