Поверхностно-активные вещества. Правило Дюкло-Траубе
Рефераты по химии / Коллоидная химия и поверхностные явления / Поверхностно-активные вещества. Правило Дюкло-Траубе
Поверхностно-активные вещества ПАВ – это вещества, способные концентрироваться на поверхности раздела фаз и понижать поверхностное натяжение жидкости. Направление процесса (концентрирования вещества в поверхностном слое фазы или выход его оттуда) определяется знаком dу/dc. Если c~a, то значению >0 соответствует отрицательная адсорбция, dу/dc<0 – положительная адсорбция. Поверхностная активность
G = - dу/dc (10)
при с→0 – адсорбция поверхностно-активных веществ положительна, адсорбция жидкостей – адсорбатов, имеющих большее поверхностное натяжение, чем у адсорбента, отрицательна.
Большинство поверхностно-активных веществ, меняющих поверхностное натяжение воды, имеет общую структуру: в молекуле содержатся гидрофильная головка и гидрофобный хвост.
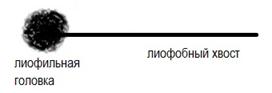
(рис.3)
При взаимодействии с водой гидрофильная головка оказывается сильно гидратированной, а гидрофобный хвост выталкивается наружу. Образуется мономолекулярный слой поверхностно-активного вещества на поверхности воды.
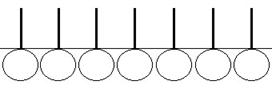
(рис.4)
Правило Дюкло-Траубе: при увеличении числа углеродных атомов в гомологическом ряду в арифметической прогрессии поверхностная активность вещества возрастает в геометрической прогрессии.
Адсорбция на твёрдой поверхности
Мономолекулярная адсорбция на твёрдой поверхности
Уравнение изотермы Ленгмюра
Основные положения теории Ленгмюра:
1. Адсорбция – процесс локализованный, она вызвана силами, близкими к химическим
2. Адсорбция протекает не на всей поверхности адсорбента, а в активных центрах
3. Каждый активный центр взаимодействует с одной молекулой адсорбата, в результате чего на поверхности адсорбента образуется один слой адсорбированных молекул
4. Адсорбция – процесс обратимый и равновесный
При адсорбционном равновесии скорость адсорбции равна скорости десорбции, она пропорциональна числу ударов молекул адсробтива о поверхность адсорбента, незанятую адсорбированными молекулами. Она равна
Wa = ka(1 – и)p (11)
ka – коэффициент пропорциональности, и – доля поверхности, покрытой адсорбированными молекулами, (1 – и) – доля свободной для адсорбции поверхности адсорбента.
Скорость десорбции:
Wд = kдни (11)
kд – коэффициент пропорциональности, н – число молекул на 1 м2 при максимальной упаковке.
Так как скорости процессов адсорбции и ресорбции равны, эти уравнения можно приравнять друг другу, и решением полученного уравнения относительно и будет
и = Kp/(1+Kp), K = ka/( kдн) (12)
Исходя из того, что число адсорбированных молекул на единице поверхности равно ин, то количество молей A на единицу поверхности равно
A = ин/NA (13)
Максимальная адсорбция:
A∞ = н/ NA (14)
Тогда уравнение изотермы адсорбции Ленгмюра, связывающее адсорбцию с давлением газа над адсорбентом имеет вид:
A = A∞ Kp/(1+Kp) (15)
Аналогичным путём выводится уравнение изотермы адсорбции Ленгмюра, связывающее адсорбцию с концентрацией:
Г = Гₒ C/(C+b) (16),
С – равновесная концентрация адсорбируемого вещества в растворе.
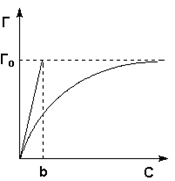
(рис.5)
На рисунке приведена изотерма мономолекулярной адсорбции [2].
Информация о химии
Ньюлендс (Newlands), Джон Александр Рейна
Английский химик Джон Александр Рейна Ньюлендс родился в Лондоне 26 ноября 1837 г. Отец, шотландский священник Уильям Ньюлендс, не хотевший, чтобы сын пошёл по его стопам, подготовил его к поступлению в в химический колледж. Мать, ...
Общая химия
О́бщая хи́мия — курс химии в ВУЗах, представляющий собой совокупность ряда разделов неорганической, органической, физической, аналитической химии, а также др. направлений химической науки. Основами современного кур ...
Лелуар (Leloir), Луис Федерико
Аргентинский биохимик Луис Федерико Лелуар родился в Париже, когда его родители, Федерико Лелуар и Ортенсиа (Агуирре) Лелуар, совершали поездку во Францию. Мальчику исполнилось два года, и семья Лелуаров возвратилась в Буэнос-Айре ...


