Прогнозирование энтропии методом статистический термодинамики
Рефераты по химии / Прогнозирование энтропии методом статистический термодинамикиСтраница 5
трет-бутильный волчок – t-Bu.xyz; изопропильный волчок – i-Pr.xyz;
метильные волчки в трет-бутильном заместителе – Me1(tbu).xyz, Me2(tbu).xyz, Me3(xyz); метильные волчки в изопропильном заместителе – Me4(ipr).xyz, Me5(ipr).xyz.
5. В программе HyperChem создается файл, полученный при выполнении команды Vibrations и содержащий набор частот колебательного спектра 224-tmp.log.
6. В приложении Entropy с использованием подготовленных ранее файлов и в соответствии с рекомендациями разд. 2.5. рассчитываются составляющие энтропии. Необходимые для расчета молекулярные данные для 2,2,4-триметилпентана приведены в табл. 2.11. В ней даны: произведение главных центральных моментов инерции (IAIBIC) для наиболее устойчивого конформера; потенциальные барьеры вращения (Vr) и приведенные моменты инерции волчков (Ir); количество максимумов на потенциальных кривых вращения (nmax) и числа симметрии волчков (σ); номера частот, отвечающих за крутильные колебания волчков, исключенные из расчета колебательного вклада.
Таблица 2.11
Молекулярные данные 2,2,4-триметилпентана
|
Волчок |
IAIBIC·10112 , г3/см6 |
Vr, Дж/моль |
Ir·1040, г/см2 |
nmax |
σ |
ν |
|
t-Bu |
1,575418 |
12472,08 |
80,51 |
6 |
3 |
1 |
|
i-Pr |
21483,39 |
69,39 |
6 |
1 |
2 | |
|
Me1(t-Bu) |
15523,51 |
5,324 |
3 |
3 |
4 | |
|
Me2(t-Bu) |
12952,77 |
5,352 |
3 |
3 |
6 | |
|
Me3(t-Bu) |
12859,60 |
5,334 |
3 |
3 |
7 | |
|
Me4(i-Pr) |
12108,83 |
5,331 |
5 |
3 |
3 | |
|
Me5(i-Pr) |
15357,90 |
5,342 |
3 |
3 |
5 |
Результаты расчета энтропии 2,2,4-триметилпентана представлены в табл. 2.12. Учитывая большое количество волчков в молекуле 2,2,4-триметилпентана и объемность некоторых из них, абсолютные значения энтропии при различных температурах рассчитаны без учета вклада на смешение конформеров. Для сравнения в табл. 2.11 приведены значения энтропии 2,2,4-триметилпентана, рекомендованные [1]. Ошибка расчета по методу статистической термодинамики возрастает с увеличением температуры от 298 до 600 К с -0,04 до -0,14 % отн. Зависимость ![]() от температуры для состояния идеального газа представлена на рис. 2.11.
от температуры для состояния идеального газа представлена на рис. 2.11.
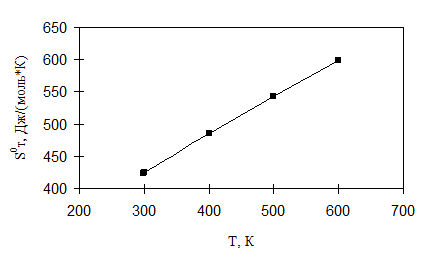
Рис. 2.11. Зависимость энтропии 2,2,4-триметилпентана от температуры
Таблица 2.12
Расчет энтропии 2,2,4-триметилпентана методом статистической термодинамики
|
T, K |
Вклады для расчета энтропии, Дж/(моль·К) |
Дж/(моль·К) |
Дж/(моль·К) | ||||
|
-Rln(σ) |
|
|
|
| |||
|
298 |
0,00 |
167,83 |
120,66 |
92,14 |
42,40 |
423,03 |
423,21 |
|
300 |
0,00 |
167,97 |
120,75 |
92,51 |
42,99 |
424,22 |
424,38 |
|
400 |
0,00 |
173,95 |
124,33 |
110,69 |
75,91 |
484,87 |
485,97 |
|
500 |
0,00 |
178,59 |
127,12 |
124,73 |
113,11 |
543,55 |
544,59 |
|
600 |
0,00 |
182,38 |
129,39 |
135,59 |
152,01 |
599,37 |
600,24 |
Информация о химии
Zn — Цинк
ЦИНК (лат. Zincum), Zn, химический элемент II группы периодической системы Менделеева, атомный номер 30, атомная масса 65,39. Свойства: серебристо-белый металл; плотность 7,133 г/см3, tпл 419,5 °С. На воздухе покрывается защи ...
Дебай (Debye), Петер Джозеф Уильям
Нидерландско-американский физик Петер Джозеф Уильям Дебай (Петрус Йозефус Вильгельмус Дебьо) родился в г. Маастрихте в Нидерландах в семье Марии Дебьо (в девичестве Рюмкенс) и Вильгельмуса Йоганнеса Дебьо, контролера фирмы по прои ...
Байер (Baeyer), Иоганн Фридрих Вильгельм Адольф фон
Немецкий химик Иоганн Фридрих Вильгельм Адольф фон Байер родился в Берлине. Он был старшим из пяти детей Иоганна Якоба Байера и Евгении (Хитциг) Байер. Отец Байера был офицером прусской армии, автором опубликованных работ по геогр ...


